Chlorid vápenatý je látka používaná ke zvýšení obsahu vápníku ve vodě, což zvyšuje celkovou tvrdost (GH). Nemá žádný vliv na karbonátovou tvrdost (KH) ani na koncentraci hydrogenuhličitanů (HCO₃⁻) či karbonátů (CO₃²⁻). Parametr Hodnota při ...
Novinky, Strana 3
Výpis článků
Síran hořečnatý heptahydrát, známý také jako epsomská sůl, je látka používaná ke zvýšení obsahu hořčíku ve vodě bez ovlivnění karbonátové tvrdosti (KH) a pH. Parametr Hodnota při dávce 1 Kg / m3 GH Zvyšuje celkovou tvrdost (...
Síran vápenatý je látka používaná ke zvýšení obsahu vápníku ve vodě bez ovlivnění karbonátové tvrdosti (KH) a pH. Často se označuje jako sádra. Parametr Hodnota při dávce 1 Kg / m3 GH Zvyšuje celkovou tvrdost (GH) díky uvoln...
Polovypálený dolomit je tepelně upravená forma dolomitu, která obsahuje oxid vápenatý (CaO) a oxid hořečnatý (MgO). Po přidání do vody výrazně ovlivňuje tvrdost, pH a alkalitu díky své reaktivitě. Parametr Hodnota při dávce 1 Kg / m3 ...
Dolomit je přírodní minerál obsahující ionty vápníku (Ca²⁺) a hořčíku (Mg²⁺) ve formě karbonátů. Používá se ke zvýšení tvrdosti vody a stabilizaci pH. Níže je popis jeho vlivu na vodní parametry: Parametr Hodnota při dávce 1 Kg / m3 ...
Uhličitan sodný je látka používaná pro úpravu vody, zejména ke zvýšení karbonátové tvrdosti (KH) a pH. Zde je přehled jeho vlivu na parametry vody: Parametr Hodnota při dávce 1 Kg / m3 GH Uhličitan sodný nezvyšuje celkovou t...
Jak rozluštit obsah chlóru v různých typech dezinfekce? Označení produktů může být zavádějící. To platí zejména pro bazénovou chemii, jako jsou různé chlórové produkty. Na první pohled se může zdát, že 99% trichlor je silnější než 68% chlornan vápen...
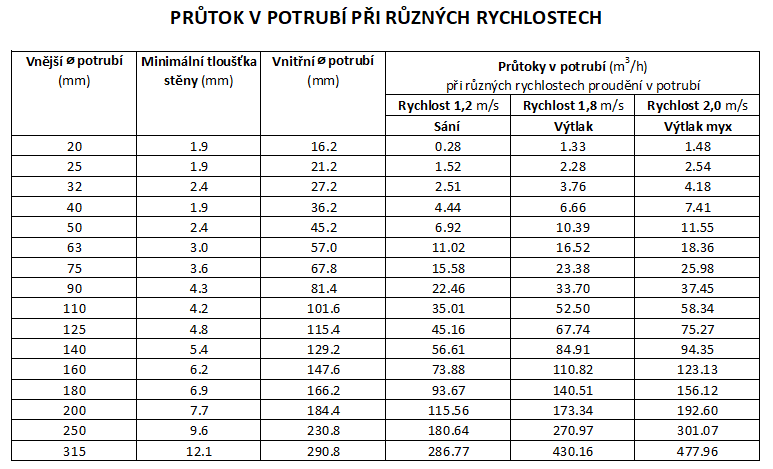
PRŮTOK V POTRUBÍ PŘI RŮZNÝCH RYCHLOSTECH ...
Možné chemické složení v přirozených vodách je možné rozdělit na anorganické (minerální) a organické. Minerální látky Hlavní příčinou obsahu minerálních nečistot v povrchových vodách jsou v první řadě splachy z povodí. Díky nim se do vody dostávaj...
Úvod a definice Elektrická vodivost nebo specifická vodivost je mírou schopnosti látky vést elektrický proud nebo přenášet elektrický náboj. Je to poměr hustoty proudu k síle elektrického pole. Pokud vezmeme v úvahu 1metrovou krychli z ...