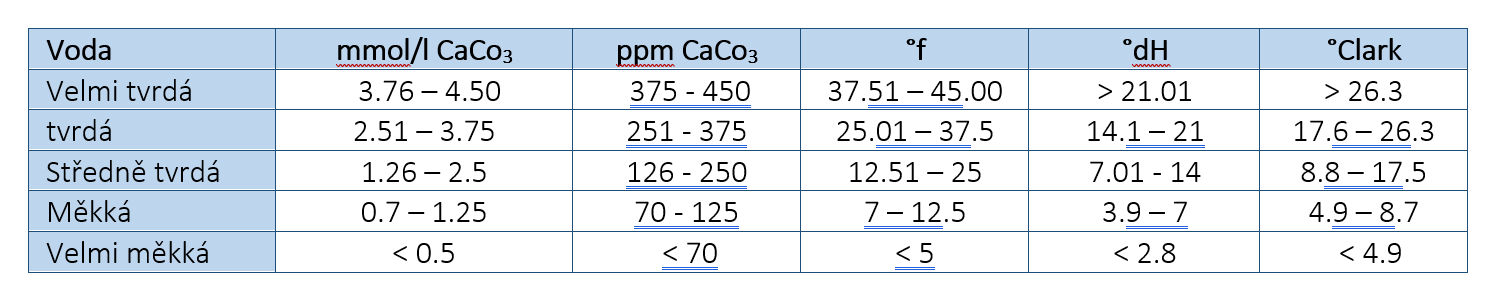
Druhy tvrdosti vody
Druhy tvrdosti vody
Jedná o rozdělení tvrdosti podle druhu aniontů, s nimiž kationty kovů tvoří soli.
Tvrdost přechodná (karbonátová)
Je tvořená hydrogenuhličitany vápenatými a hořečnatými, tedy sloučeninami uhličitanových aniontů a vápeno-hořečnatých kationtů. Tato sůl je za normálních podmínek ve vodě dobře rozpustná, ovšem v důsledku změny rovnováhy mezi oxidem uhličitým, pH a hydrogenuhličitany, např. při zahřívání, se může snadno změnit na nerozpustné uhličitany. Tyto sloučeniny se pak projevují jako tzv. vodní nebo kotelního kámen, který nejčastěji můžeme pozorovat, jak ulpívá na teplonosných plochách.
Přechodná, nebo také karbonátová či uhličitanová tvrdost vody, nebo také alkalita, je dána obsahem všech zásaditě reagujících látek. Vzhledem k tomu, že přechodná tvrdost nemůže být větší než alkalita, zjistíme jen maximální možnou hodnotu přechodné tvrdosti. Skutečná hodnota přechodné tvrdosti však bývá i podstatně nižší než naměřená hodnota alkality. Alkalita nebo také kyselinová neutralizační kapacita (KNK) je vlastně mírou acido-bazické stability, dané hodnotou pH. Mluvíme o ní také jako o pufrační (tlumivé) kapacitě vody. Pufry (tlumiče) jsou látky, které mají schopnost neutralizovat kyseliny a zásady a udržují stabilitu resp. hodnotu pH na určité úrovni.
Přechodnou tvrdost (alkalitu) vody snížíme převařením vody, kdy se vysráží tzv. kotelní kámen, kyselinou chlorovodíkovou, nebo sírovou kde dojde i ke snížení jak alkality tak pH.
Měření Měření se provádí pomocí fotometrů. Přepočet Stupně uhličitanové tvrdosti (dKH nebo °KH, Karbonathärte) 1 dKH = 17,86 mg = 17,86 ppm
Přechodnou tvrdost zvýšíme také například přidáním hydrogenuhličitanem sodným (jedlá soda).
Tvrdost trvalá (nekarbonátová)
Je tvořená jiným typy solí např. vápenatými a hořečnatými než jsou hydrogenuhličitany (např. sírany, chloridy, dusičnany, křemičitany, humáty). Tento typ tvrdosti se změnou teploty nebo tlaku nemění. Soli zůstávají v rozpustné formě a z vody se nevysráží, proto ji nazýváme jako tvrdost trvalou. Koncentrace iontů vápníku a hořčíku vázaných na neuhličitanové ionty tedy nejde snížit tak jednoduše jako u tvrdosti přechodné. Výhodou však je, že se za tepla nevysráží ve formě vodního kamene a tím odpadá problém s inkrustacemi potrubí či teplonosných ploch, povlaků vodního kamene na povrchu čaje a jiných negativních projevů tvorby vodního kamene. Tvrdost trvalá pak bývá v některých literaturách dále rozdělena dle příslušných aniontů na tvrdost chloridovou, síranovou atd. dle příslušných aniontů ve vytvořených solích. Celková tvrdost je pak součtem trvalé a přechodné tvrdosti.
K jejich odstranění používáme srážení působením hydroxidu vápenatého a uhličitanu sodného, čímž se rozpustné hydrogenuhličitany a sírany převedou na méně rozpustné uhličitany - uhličitan vápenatý a hydroxid hořečnatý. Odstranit stálou tvrdost vody můžeme pomocí iontoměničových pryskyřic. Systém odstraňování je v cyklu OH- a H+, kdy silně kyselé katexy v cyklu H+ zachycují všechny kationty a mění je za anionty vodíku a silně bazické anexy v cyklu OH- zachycují všechny anionty a mění je za ionty hydroxylové.
Zvýšit ji můžeme přidáním chloridem vápenatým, chloridem hořečnatým, nebo průtokem přes filtrační kolonu s uhličitanem vápenatým, nebo polovypáleného dolomitu. Při zvyšování tvrdosti vody zvyšujeme i její vodivost resp. mineralizaci.