Základy měření ORP
Základy měření ORP

ORP (mV) je zkratka pro oxidačně-redukční potenciál. V dnešní době se mu také říká „redoxní potenciál“. Jinými slovy, je to úroveň energie (elektrický potenciál) určená rovnovážnými podmínkami mezi oxidanty (Mz + ) a redukčními činidly (M (zn)+ ), které koexistují v roztoku.
Předpokládejme, že v řešení existuje pouze následující jediná rovnovážná podmínka ①:
![]()
Když se do tohoto roztoku vloží kovová elektroda (platina, zlato atd.) a referenční elektroda a změří se potenciální rozdíl mezi těmito elektrodami nebo ORP (mV) pomocí potenciometru (milivoltmetrová funkce pH metru), potenciálový rozdíl lze obecně vyjádřit následující rovnicí:
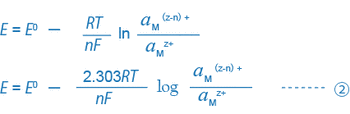
Například rovnice ① a ② pro řešení, kde koexistují trojmocné a dvojmocné ionty železa, lze vyjádřit následovně:
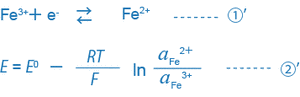
Pokud v řešení existuje pouze jediná podmínka rovnice ①', ORP tohoto řešení je jednoznačně určeno rovnicí ②'.
Zde je důležité, že o ORP (mV) rozhoduje poměr aktivity redukčního činidla (Fe 2+ ) k aktivitě oxidantu (Fe 3+ ), neboli (a Fe 2+/ a Fe 3+ ) . Ve skutečnosti existuje v roztoku současně mnoho různých podmínek rovnováhy mezi různými ionty. ORP (mV) takového řešení tedy nelze vyjádřit touto jednoduchou rovnicí a fyzikální nebo vědecký význam ORP zjištěné rovnicí není tak jasný.
Proto musíte pochopit, že ORP (mV) roztoku je jedním z měřítek vlastností tohoto roztoku. Na druhé straně je měření ORP (mV) široce používáno pro analýzu roztoků (potenciometrická titrace) nebo jako užitečný indikátor při čištění odpadních vod.
V poslední době se uvádí, že vysoký ORP (mV) má sterilizační účinek a že pokud pijete vodu s nízkým ORP (mV), její reakce s aktivním kyslíkem v buňkách těla vás činí méně náchylnými k nemocem. ORP se také používají jako indikátor alkalické pitné vody.
Typy referenčních elektrod a ORP (mV)
Naměřený ORP (mV) je hodnota pro použitou referenční elektrodu. Zdá se tedy, že měření ORP (mV) roztoku závisí na typu referenční elektrody. Referenční elektrody Fi LAB používají Ag/AgCl s vnitřním roztokem 3,33 mol/l KCl.
V obecných akademických pracích se jako referenční elektrody často používají standardní vodíkové elektrody (SHE nebo NHE) a vztah mezi ORP (mv), když se jako referenční elektroda používá NHE, a tím, když je elektroda Ag/AgCl s 3,33 mol/ L KCl se používá jako referenční elektroda může být vyjádřena následující rovnicí:
![]()
EN N.HE : Měření ORP (mV), když je jako referenční elektroda použita normální vodíková elektroda (NHE)
E : Měření ORP (mV), když je jako referenční elektroda použita Ag/AgCl elektroda s 3,33 mol/L KCl
Další podrobnosti naleznete v části „Základy pH – elektrický potenciál referenční elektrody“. “
Pozitivní a negativní známky elektrických potenciálů
V knihách souvisejících s elektrochemií nebo analytickou chemií se příklady jako ty uvedené níže používají jako standardní oxidačně-redukční potenciály:
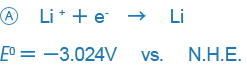
V některých jiných knihách jsou však kladná a záporná znaménka uvedena opačně (zejména v knihách napsaných v USA).
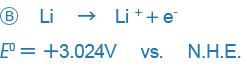
Příklad jako B pouze vyjadřuje reakci opačným způsobem a mezi těmito dvěma výrazy není žádný podstatný rozdíl, ale rozdíl ve způsobu použití znaků může být matoucí. V současné době se způsob použití znaku v A používá na většině míst po celém světě a my také tento způsob vyjadřování ORP.
Tato smlouva se nazývá Stockholmská úmluva Mezinárodní unie čisté a aplikované chemie (IUPAC). Zjednodušeně řečeno, značky se používají tak, že šipky ukazují směr, kterým se hlavní chemické látky mění z oxidantu na redukční činidlo.
